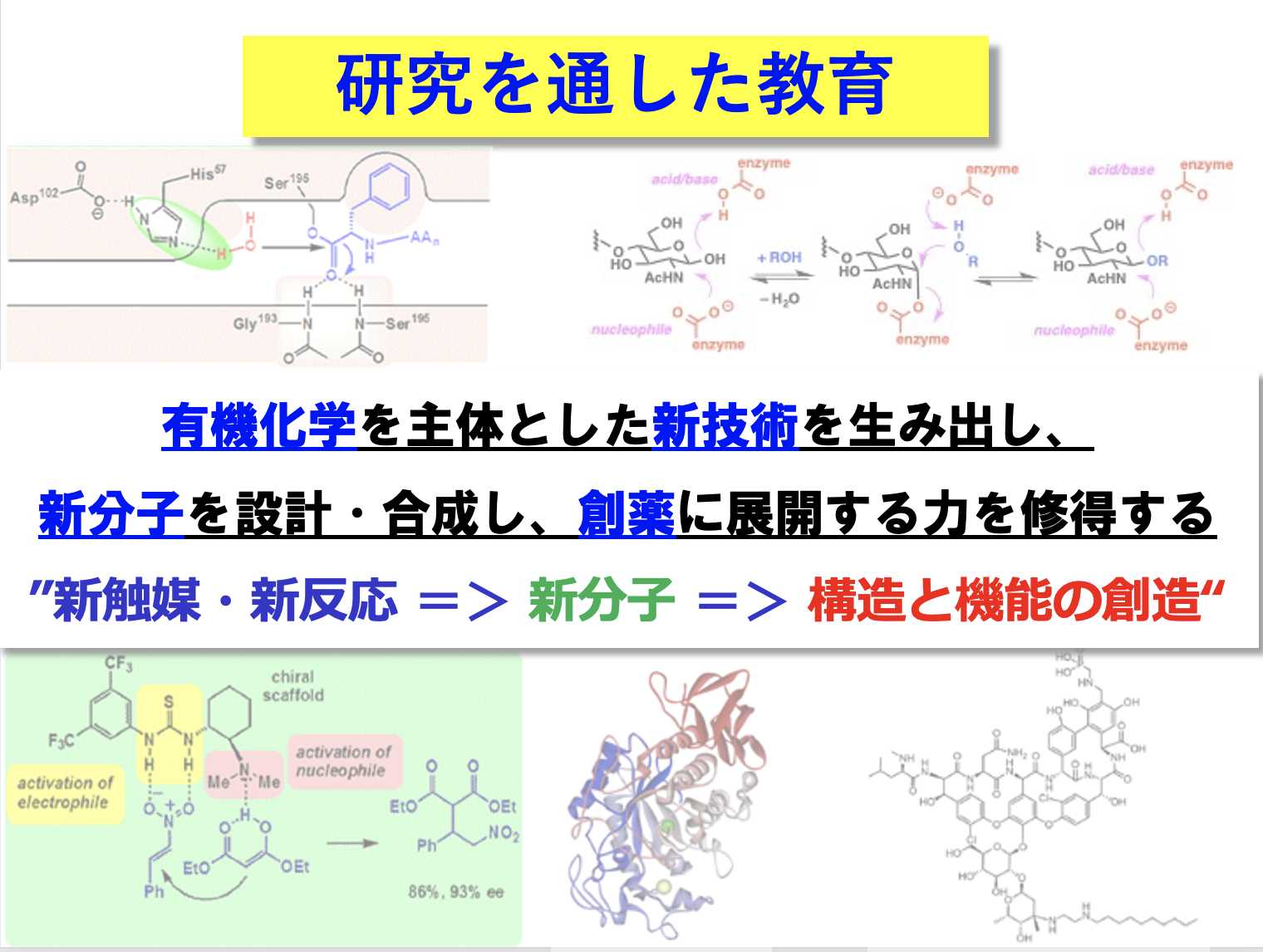
研究概要
有機化学とは有機分子の物性、構造そして反応性を理解し、これを自在に操ることで、これまで無かった様々な機能を発揮する新しい有機分子を創製する学問です。このことは、まさに薬学における有機化学の役割と重要性を示しています。疾患の治療には、有機反応によって構成、制御されている生体反応の本質的な理解と、有機化合物である薬の自在合成が不可欠です。私たちの研究室では、有機化学における新現象の発見を基盤として創薬科学に貢献すべく、くすりの創と造に関する新しい技術の開発と生命現象の解明に取り組んでいます。学生の皆さんには、研究活動を通して有機化学を主体とした新技術を生み出し、新しい分子を設計・合成し、創薬に展開する力を修得していただくことを期待しています。
医薬品は低分子主体の時代から、中分子や高分子からなる抗体・ペプチド・核酸あるいはそのハイブリッドという多様化したニューモダリティへとパラダイムが移っています。この新しいパラダイムでは、複雑で大きな分子をいかに効率的に合成するかが重要です。その合成法を我々は独自で開発しています。さらに、環境や資源枯渇の問題に対峙したグリーンケミストリーにも配慮して、よりクリーンで安全・安価な医薬品の合成法を開発しています。分子が大きいと官能基の種類と数が増え、官能基選択性や位置選択性の制御が問題になってきます。計算化学とデータサイエンスはこの難題を打破する有効なツールです。学生のみなさんにとっても、ウェットのみならずドライの研究も実行する力はアカデミアと製薬会社の両方で重要であると考えています。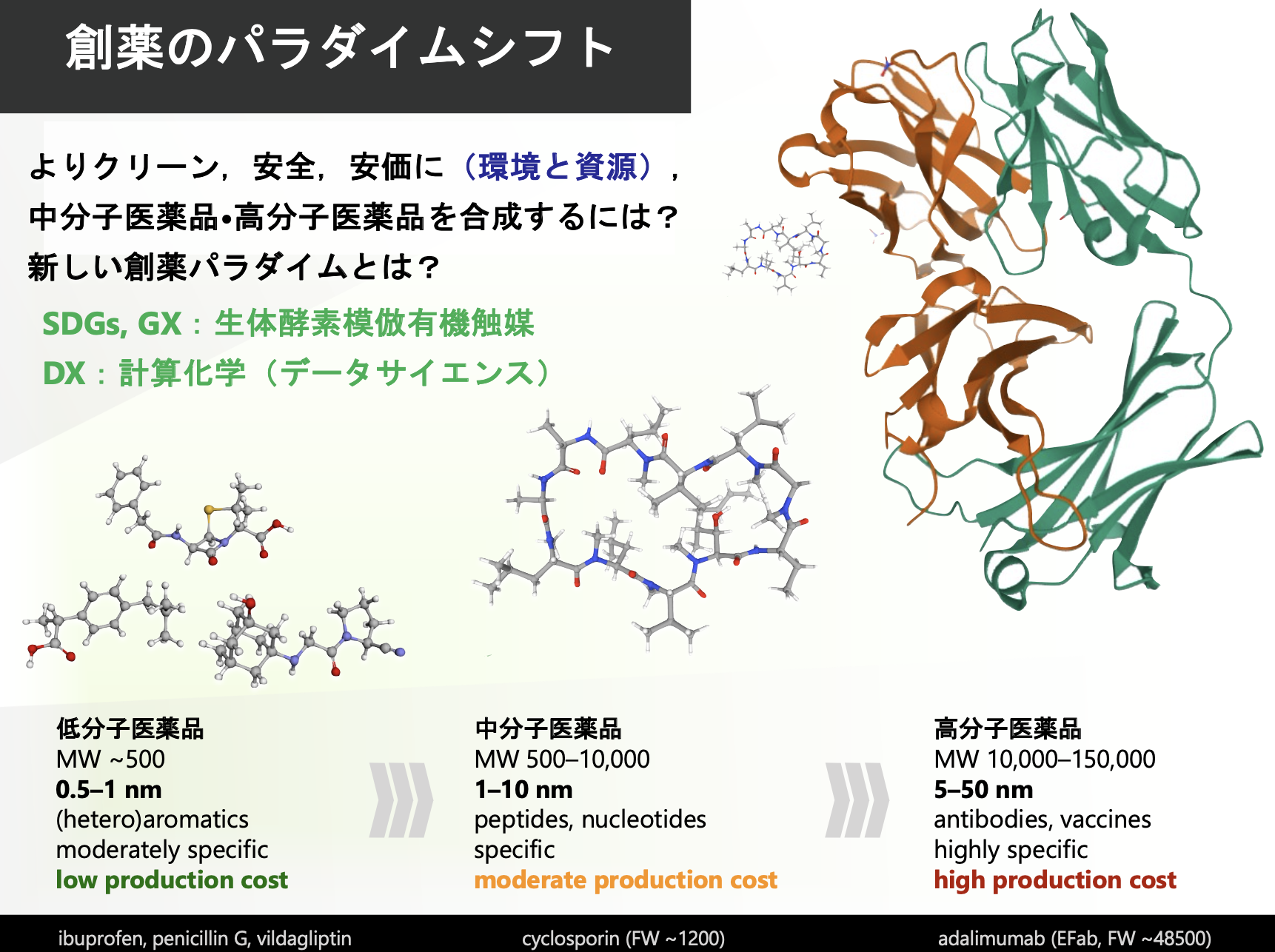
1.グリーン人工酵素触媒の設計:二官能性有機触媒の化学
生体内でさまざまな機能を担っている巨大な生体分子を模倣して、小型ながらも類似した機能を持つ有機小分子を作り出すことはできないだろうか?これが人工生体触媒を合成しようとした出発点でした。いろいろ検討した結果、セリンプロテアーゼという酵素をモデルとして、分子内にアミノ基を有するチオウレア触媒の開発に成功しました。この触媒は適切な三次元空間に、求電子剤を活性化するチオウレア部位と、求核剤を活性化するアミノ基を有するため、ほぼ中性条件下でさまざまな反応を立体選択的に進行させることができます。現在は、竹本触媒(Takemoto Catalyst)として認知されています。このような有機触媒は従来の金属触媒と比較して、安全性、利便性、経済性などに優れており、医薬品製造の実用的なツールとなります。我々は幾つかの医薬品の合成を完成させており、現在、より高機能な触媒の開発を目指して、糖転移酵素や非リボソームペプチド合成酵素を凌駕する人工触媒の開発を進めています。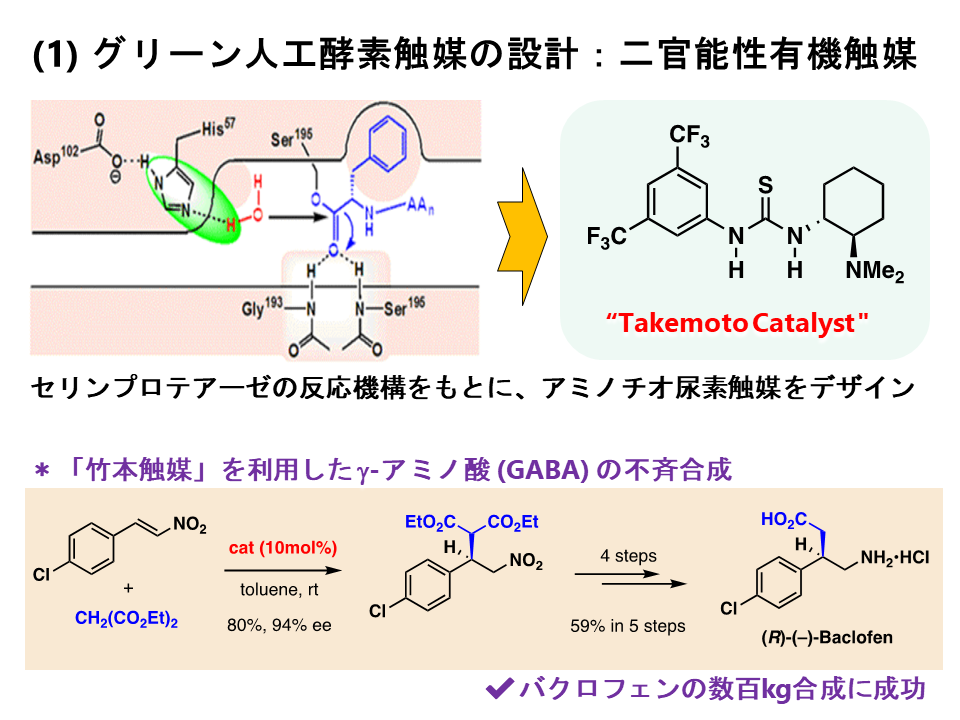
- Yumura, T.;Nanjo, T.; Takemoto, Y.
“A Benzophenothiazine/Boronic Acid Hybrid Photocatalyst Enables the Single Electron Transfer (SET) to Carboxy Groups: SET-Initiated Cyclization of α,β-Unsaturated Carboxylic Acids”
ACS Catal., 2023, in press. DOI: 10.1021/acscatal.3c03662 - Tokuhiro, Y.; Yoshikawa. K.; Murayama, S.; Nanjo, T.; Takemoto, Y.
“Highly Stereoselective, Organocatalytic Mannich-type Addition of Glyoxylate Cyanohydrin: A Versatile Building Block for the Asymmetric Synthesis of β-Amino-α-ketoacids”
ACS Catal., 2022, 12, 9, 5292-5304. DOI: 10.1021/acscatal.2c00950 - Kato, N.; Nanjo, T.; Takemoto, Y.
“A Pyridine-Based Donor-Acceptor Molecule: A Highly Reactive Organophotocatalyst That Enables the Reductive Cleavage of C-Br Bonds through Halogen Bonding”
ACS Catal., 2022, 12, 7843-7849. DOI: doi.org/10.1021/acscatal.2c02067 - Tsukano, C.; Yagita, R.; Heike, T.; Mohammed, T. A. A.; Nishibayashi, K.; Irie, K.; Takemoto, Y.
“Asymmetric Total Synthesis of Shagenes A and B”
Angew. Chem. In. Ed., 2021, 60, 23106-23111. DOI: 10.1002/anie.202109786
2.重水素化による分子機能開拓
医薬品に含まれる一部の水素原子だけを重水素へと置き換えることで、代謝酵素の分解を受けにくくなる重水素化医薬品(重薬)の開発が最近活発化しています。通常、重水素化された医薬分子を合成するためには、重水素化された原料を利用して何回も合成反応をおこなってつくる必要があります。我々は、触媒の力で、医薬品に含まれる決まった水素原子だけを、一段階で重水素に置き換えることはできないか?と考えて研究に取り組んでいます。最近、イリジウム触媒を使ってヒドロキシ基の隣の水素だけを選択的に重水素化する反応を見出して、重水中で一段階で簡便に医薬品を重水素化できることがわかりました。鍵は、イリジウム触媒のもつ脱水素化・同位体交換・水素化という三つの反応性をうまく連結した点にあります。実際に我々が合成した重水素化された医薬品(ロサルタン-d2)は、代謝酵素による分解速度が下がることも明らかになりました。また、医薬品だけでなく、有機触媒も重水素化することで頑健性が高まることを明らかにしています。今さらに、重水素化に関わる新しい化学と技術を探索しています。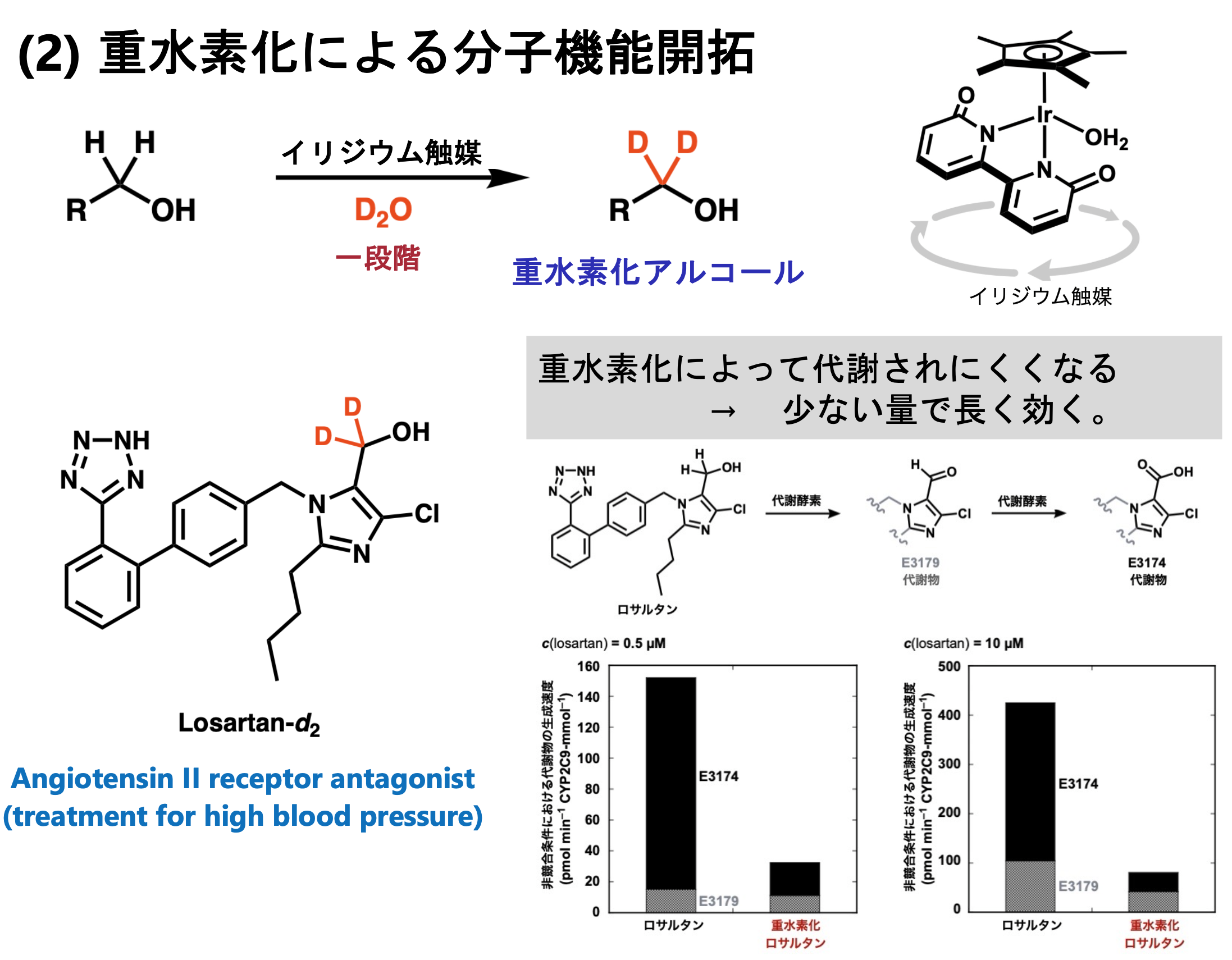
- Murayama, S.; Li, Z.; Liang, H.; Liu, Y.; Naka, H.; Maruoka, K.
“Impact of Catalyst Deuteration on the Reactivity of Chiral Phase-Transfer Organocatalysts”
Chem. Eur. J. 2023, in press. DOI: 10.1002/chem.202301866 - Itoga, M.; Yamanishi, M.; Udagawa, T.; Kobayashi, A.; Maekawa, K.; Takemoto Y.; Naka, H.
“Iridium-Catalyzed α-Selective Deuteration of Alcohols”
Chem. Sci., 2022, 13, 8744-8751. DOI: doi.org/10.1039/D2SC01805E プレスリリース 日刊工業新聞 - Liang, H.; Li, Z.; Liu, Y.; Murayama, S.; Naka, H.; Maruoka, K.
“Synthesis of Optically Pure, Deuterated Maruoka Catalysts and Their Chemical Reactivity”
Tetrahedron Lett., 2022, 96, 153753. DOI: 10.1016/j.tetlet.2022.153753
3.触媒を利用したピンポイント分子修飾法
中分子や大分子をピンポイントで化学修飾できないか?この課題に合成化学で答えを出す研究を進めています。例えば、ペプチド医薬品はアミノ酸を連結して合成されますが、ここにふくまれる重要なアルキル側鎖を違う側鎖に変えたいという場合は、アミノ酸の原料に戻ってまた一から合成しないといけません。最近我々は、出来上がったペプチドを原料に、一段階で色んなものを合成する方法を開発しました。その鍵が主鎖のアミドのNHを選択的に塩素化する反応です。生成したクロロ化ペプチドは、デヒドロ化されたペプチドや、多様な官能基を導入されたペプチドへと変換することができます。すなわち、側鎖を任意に改良修飾する技術です。現在、配列選択的にペプチドのNHを反応させる触媒の開発に取り組んでいます。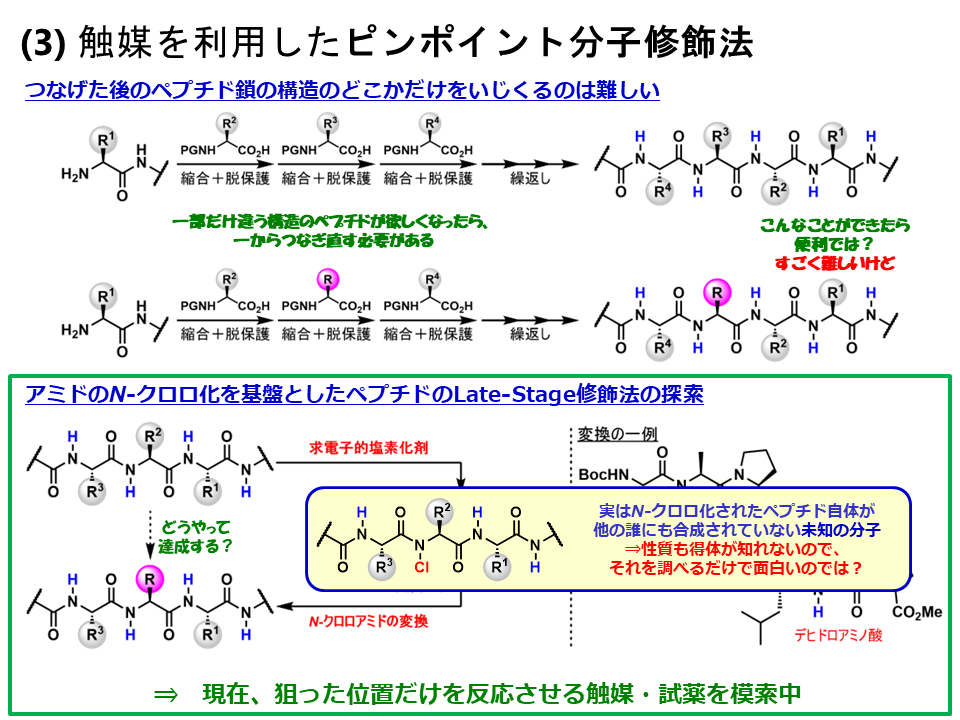
- Nanjo, T.; Matsumoto, A.; Oshita, T.; Takemoto, Y.
“Synthesis of Chlorinated Oligopeptides via γ- and δ-Selective Hydrogen Atom Transfer Enabled by the N-Chloropeptide Strategy”
J. Am. Chem. Soc. 2023, 145, 19067–19075. press release DOI: 10.1021/jacs.3c06931 - Nanjo, T.; Oshita, T.; Matsumoto, A.; Takemoto, Y.
“Late-Stage Installation of Dehydroamino Acid Motifs into Peptides Enabled by an N-Chloropeptide Strategy”
Chem. Eur. J., 2022, 28, e202201120. DOI: doi.org/10.1002/chem.202201120 - Nanjo, T.; Matsugasako, T.; Maruo, Y.; Takemoto, Y.
“Photocatalytic C–O Bond Cleavage of Alcohols Using Xanthate Salts”
Org. Lett., 2022, 24, 359-363. DOI: 10.1021/acs.orglett.1c04029
